У веома корозивном окружењу, онлајн праћење спектроскопије постаје ефикасан метод истраживања.
Литијум бис(флуоросулфонил)амид (ЛиФСИ) се може користити као адитив за електролите литијум-јонских батерија, са предностима као што су висока густина енергије, термичка стабилност и сигурност.Будућа потражња постаје све очигледнија, што је чини жаришном тачком у истраживању материјала нове енергетске индустрије.
Процес синтезе ЛиФСИ укључује флуорисање.Дихлоросулфонил амид реагује са ХФ, где је Цл у молекуларној структури замењен са Ф, стварајући бис(флуоросулфонил)амид.Током процеса настају међупроизводи који нису у потпуности замењени.Услови реакције су строги: ХФ је веома корозиван и изузетно токсичан;реакције се дешавају под високом температуром и притиском, што процес чини веома опасним.
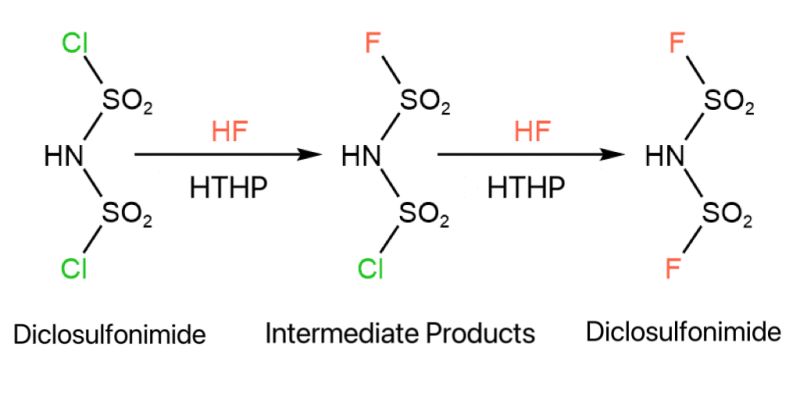
Тренутно се многа истраживања ове реакције фокусирају на проналажење оптималних услова реакције како би се максимизирао принос производа.Једина техника ванмрежне детекције доступна за све компоненте је спектар Ф нуклеарне магнетне резонанце (НМР).Процес откривања је изузетно сложен, дуготрајан и опасан.Током реакције супституције, која траје неколико сати, притисак се мора ослободити и узорци узимати сваких 10-30 минута.Ови узорци се затим тестирају Ф НМР да би се одредио садржај међупроизвода и сировина.Циклус развоја је дуг, узорковање је сложено, а процес узорковања такође утиче на реакцију, чинећи податке теста нерепрезентативним.
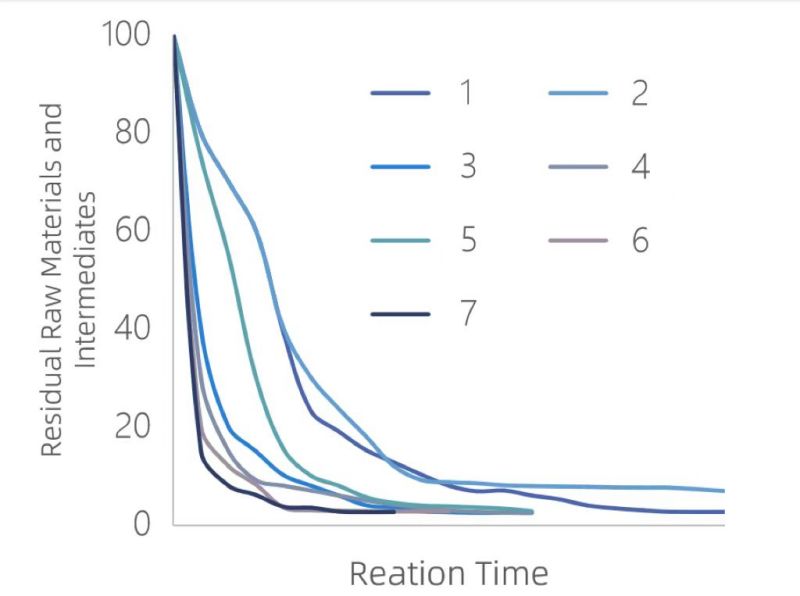
Међутим, технологија за праћење на мрежи може савршено да реши ограничења ван мреже.У оптимизацији процеса, онлајн спектроскопија се може користити за праћење ин ситу концентрација реактаната, међупроизвода и производа у реалном времену.Сонда за урањање директно сеже испод површине течности у реакционом котлићу.Сонда може да издржи корозију од материјала као што су ХФ, хлороводонична киселина и хлоросулфонска киселина и може толерисати температуре до 200°Ц и притисак од 15 МПа.Леви графикон приказује онлајн праћење реактаната и међупроизвода у оквиру седам параметара процеса.Под параметром 7, сировине се најбрже троше, а реакција се завршава најраније, што је чини најбољим реакционим условом.

Време поста: 23.11.2023

